Studienteilnehmende gesucht: MHH-Kooperationsprojekt untersucht die Rolle des antimikrobiellen Proteins RNase 7 bei der Abwehr von Herpes-simplex- und Varicella-Zoster-Viren.

Wollen die Rolle der RNase 7 bei der Virenabwehr auf der Haut aufklären: Professor Dr. Thomas Werfel und Dr. Katinka Döhner. Copyright: Karin Kaiser / MHH.
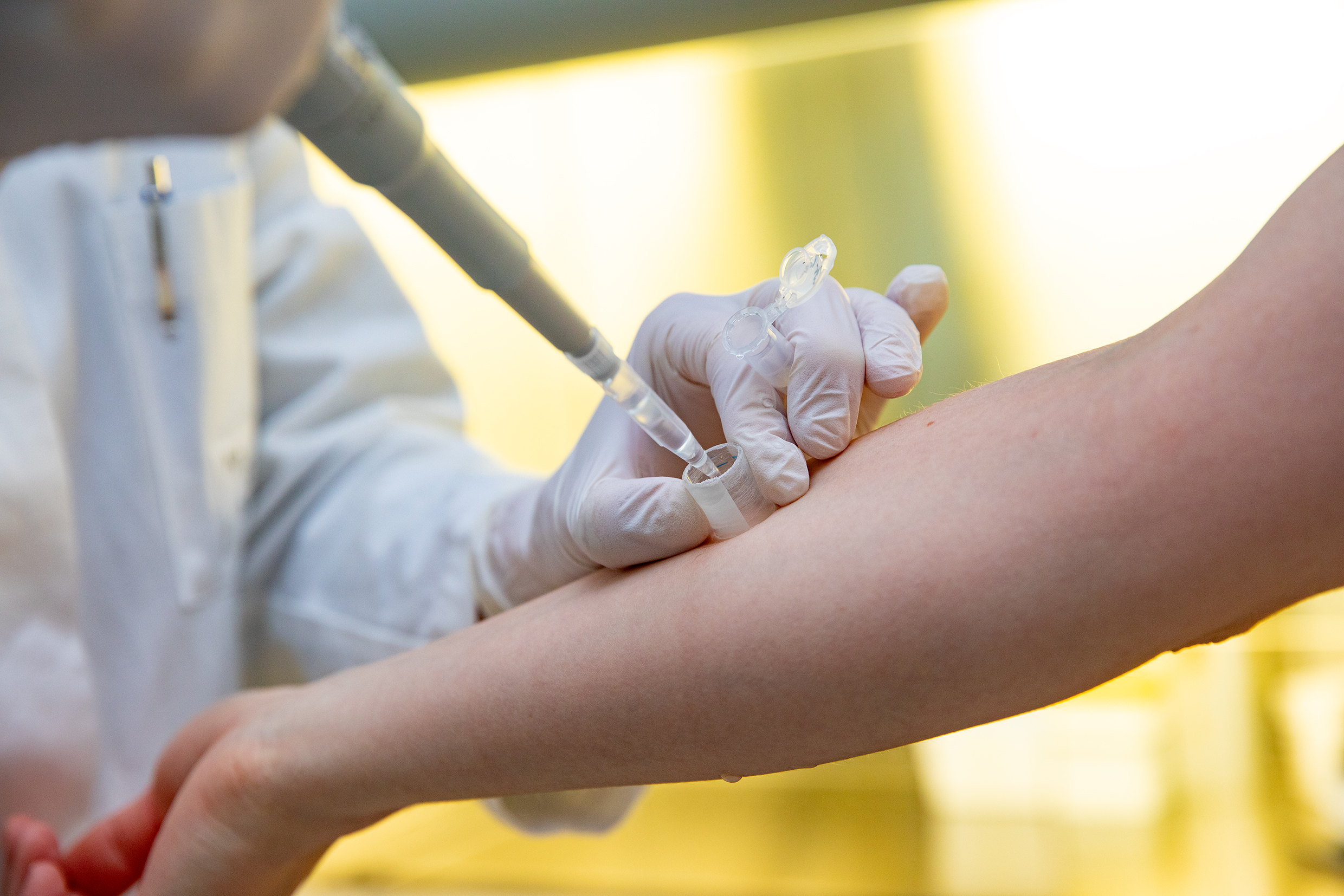
Mit Hilfe des Spülzylinders werden die antimikrobiellen Proteine und Peptide aus einem kleinen, definierten Hautbereich gewonnen. Copyright: Karin Kaiser / MHH
Unsere Haut bildet eine wichtige Barriere gegen Krankheitserreger. Zur ersten Verteidigungslinie gehören sogenannte antimikrobielle Proteine und Peptide (AMP) des angeborenen Immunsystems, die in den oberen Hautschichten gebildet werden. Eines dieser AMP heißt RNase 7 und greift verschiedene Bakterien und Pilze an. Dass RNase7 auch gegen Herpes-simplex-Viren (HSV) aktiv ist, hat die Arbeitsgruppe von Professor Dr. Thomas Werfel, Direktor der Klinik für Dermatologie, Allergologie und Venerologie der Medizinischen Hochschule Hannover (MHH), kürzlich herausgefunden. Herpes-simplex-Viren gehören zu den Alpha-Herpesviren und verursachen in der Regel leichte Symptome wie Lippenbläschen. Durch wiederkehrende Infektionen des Auges kann es aber auch zu Vernarbungen der Hornhaut und damit zu Beeinträchtigungen des Sehvermögens kommen. Auch auf der Haut lösen sie mitunter schwere, ausgebreitete Infektionen aus, in der Fachsprache als Eczema herpeticatum bezeichnet. Im Exzellenzcluster RESIST forscht Professor Werfel unter anderem zu der Frage, welche Mechanismen bei Menschen mit Neurodermitis zu solchen schweren Krankheitsverläufen nach Herpesinfektionen führen.
Studien an Patientinnen und Patienten aus der in RESIST entstandenen HSV-Kohorte und aus dem deutschen Neurodermitisregister haben gezeigt, dass 22 Prozent der mäßig bis schwer an Neurodermitis Erkrankten schon mindestens einmal unter Eczema herpeticatum litten. In Kooperation mit der Klinik für Dermatologie des Universitätsklinikums Schleswig-Holstein, dem MHH-Institut für Virologie und dem MHH-Institut für Toxikologie möchten Professor Werfel und seine Mitarbeiterin Dr. Katinka Döhner jetzt herausfinden, welche Rolle RNase 7 bei der verstärkten Anfälligkeit dieser Untergruppe von Neurodermitis-Betroffenen spielt. Die Deutsche Forschungsgemeinschaft fördert das Projekt mit rund 750.000 Euro. Davon erhält die MHH 460.000 Euro.
Molekulare Mechanismen aufklären
Die Forschenden beschäftigen sich schon über einen längeren Zeitraum mit den Effekten antimikrobieller Peptide der Haut. „In diesem Zusammenhang konnten wir zeigen, dass freie DNA, die auf entzündeter Haut bei Neurodermitis verstärkt nachweisbar ist, zu einer Schwächung der antimikrobiellen Wirksamkeit von RNase 7 und anderen AMP führt“, sagt Professor Werfel. „Außerdem haben die Kieler Kolleginnen und Kollegen in Kooperation mit uns festgestellt, dass ein Protein, das RNAse 7 hemmt, in der Haut von Neurodermitis-Betroffenen vermehrt produziert wird.“ Bislang ist aber noch nicht klar, ob die größere Anfälligkeit gegen Herpesviren nun daran liegt, dass die Betroffenen bei beginnenden Herpesinfektionen auf ihrer Haut einfach weniger RNase 7 zur Verfügung haben als gesunde Menschen oder ob der Angriff des Proteins gegen die Viren bei ihnen schwächer ausfällt. Dafür will die Biochemikerin Dr. Döhner die molekularen Mechanismen von RNase 7 aufklären. Die Untersuchungen werden an menschlichen Keratinozyten-Kulturen vorgenommen, spezialisierten Zellen aus der Epidermis, der äußeren Hautschicht. Die AMP-Konzentration auf der Haut überprüfen die Forschenden, indem sie mit Hilfe eines sogenannten Spülzylinders einen kleinen, definierten Hautbereich mehrfach mit einer seifehaltigen Kochsalzlösung spülen.
Aktivität gegen verwandtes Windpocken-Virus überprüfen
Zum einen möchten die Forschenden verstehen, welche Schritte im Infektionsverlauf durch RNase 7 gehemmt werden und mit welchen viralen und zellulären Faktoren RNase 7 interagiert. Zum anderen wollen sie herausfinden, ob es Unterschiede in der Bildung, Freisetzung und Aktivität von RNase 7 und weiteren antimikrobiellen Proteinen zwischen Neurodermitis-Patienten mit oder ohne Eczema herpeticatum und hautgesunden Menschen gibt. „Wir prüfen daher auch, ob die antivirale Aktivität von RNase 7 tatsächlich durch einen RNase-Inhibitor gehemmt wird“, sagt Dr. Döhner. Des Weiteren wollen die Forschenden untersuchen, ob RNase 7 auch aktiv gegen die mit Herpes-simplex-Viren verwandten Varicella-Zoster-Viren ist. Diese ebenfalls zu den Alpha-Herpesviren zählenden Krankheitserreger verursachen bei Kindern Windpocken und können nach ihrer Reaktivierung bei Erwachsenen – oft bei älteren Menschen – Gürtelrose hervorrufen.
Mögliche Ergänzung für antiviralen Wirkstoff
Die beiden im Projekt untersuchten Alpha-Herpesviren „verstecken“ sich sozusagen im Körper und entgehen so der Zerstörung durch die Abwehrzellen des Immunsystems. „Wir finden häufig Antikörper bei den Neurodermitis-Betroffenen, die aber als Schutz offenbar nicht ausreichen“, sagt Professor Werfel. „Seitdem wir wissen, dass RNase 7 gegen Herpes-simplex-Viren aktiv ist, nehmen wir an, dass dieser direkte Angriff ein wichtiger Mechanismus bei hautgesunden Menschen ist.“ Behandelt werden schwere Herpes-simplex-Infektionen daher innerlich mit dem Wirkstoff Aciclovir, der die Virusvermehrung in den Körperzellen stoppt. Ein weiteres Medikament zu inneren Anwendung (Pritelivir) ist derzeit in klinischer Erprobung. Können die Forschenden die Rolle von RNase 7 aufklären, wäre das antimikrobielle Protein in Zukunft möglicherweise eine sinnvolle Ergänzung dieser antiviralen Therapie – etwa als Zusatz in Cremes und Salben.
Studienteilnehmende gesucht
Für die Studie werden noch Probandinnen und Probanden gesucht. Teilnehmen können Patientinnen und Patienten mit bekannter Neurodermitis und einer Vorgeschichte mindestens einer Episode einer schweren Herpesinfektion, die innerlich behandelt werden musste. Telefonische Anmeldung unter (0511) 532-5086. Mehr Informationen zu den klinischen Studien im Bereich Immundermatologie und experimentelle Allergologie gibt es hier.
Eine Zusammenfassung der Originalarbeit zur Hemmung von RNase 7 auf der entzündeten Haut von Neurodermitis-Betroffenen „Inhibition of RNase 7 by RNase inhibitor promotes inflammation and Staphylococcus aureus growth: Implications for atopic dermatitis“ finden Sie hier.
Text: Kirsten Pötzke